Il calore latente
Che cos’è il calore latente? Vediamolo insieme.
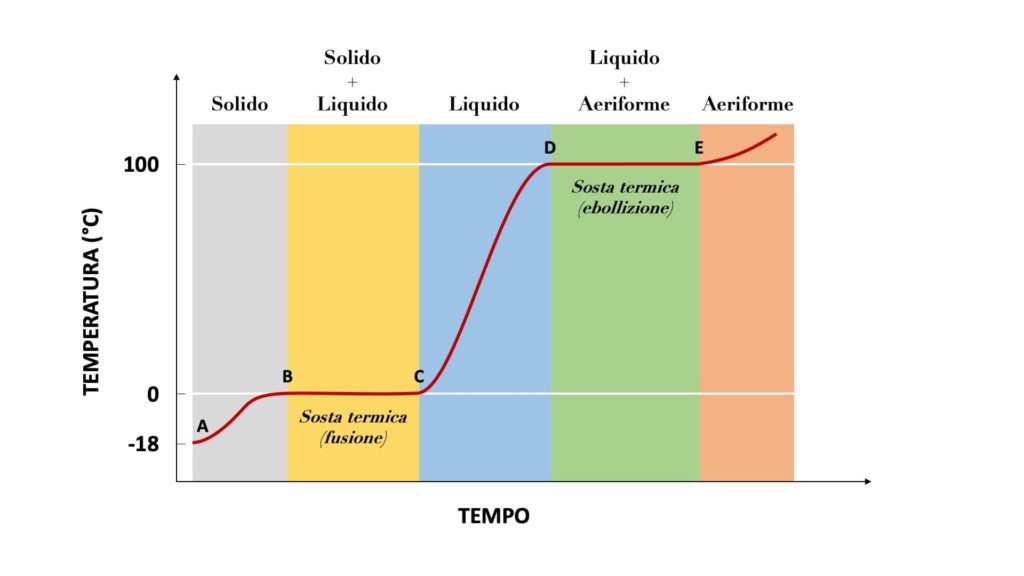
Se forniamo o sottraiamo calore a una sostanza, la sua temperatura rispettivamente si alza o si abbassa.
Durante i passaggi di stato però, quando la sostanza è a metà tra uno stato e un altro (ad esempio, un po’ solida e un po’ liquida), la sua temperatura non varia, anche se forniamo o sottraiamo calore.
Questo calore che viene assorbito o rilasciato dalla sostanza durante un passaggio di stato e che non determina un aumento o una diminuzione della sua temperatura viene chiamato calore latente.
Come si misura?
Il calore latente si misura in J/kg (joule al chilogrammo) ed è rappresentato dalla lettera greca λ (lambda).
Grazie ad esso possiamo ricavare il calore che serve a una sostanza per passare del tutto da uno stato a un altro:
Q=λ\ ·m
In questa formula Q rappresenta il calore necessario per un passaggio di stato completo, λ il calore latente e m la massa della sostanza.
In altre parole, il calore che serve a una sostanza per passare del tutto da uno stato a un altro è uguale al calore latente per la massa della sostanza.
Che effetto ha il calore latente?
Se il calore latente non fa né aumentare né diminuire la temperatura della sostanza, allora che effetto ha?
A seconda del passaggio di stato che si verifica, il calore latente favorisce o rompe i legami intermolecolari della sostanza, permettendole così di cambiare completamente stato.
Quando ad esempio una sostanza passa da solida a liquida, esso rompe i legami intermolecolari, finché a un certo punto avviene per intero il passaggio di stato (se invece la sostanza passasse da liquida a solida, i legami intermolecolari verrebbero favoriti).
Ciascun passaggio di stato ha un calore latente specifico, che, a parità di massa della sostanza, è uguale a quello del passaggio di stato inverso (ovviamente con segno opposto):
- c. l. di fusione (λf)
- c. l. di solidificazione (λs)
- c. l. di ebollizione (λe)
- c. l. di condensazione (λc)
- c. l. di sublimazione (λsub)
- c. l. di brinamento (λb)
Ad esempio, per 1 kg di azoto il c. l. di fusione è 2,57 · 104 J/kg, mentre quello di ebollizione è 2,00 · 105 J/kg. Inoltre, quello di solidificazione (cioè il passaggio di stato inverso alla fusione) è -2,57 · 104 J/kg.
Il c. l. di sublimazione è dato dalla somma di quello di fusione e di quello di ebollizione. Allo stesso modo, il c. l. di brinamento è dato dalla somma di quello di solidificazione e di quello di condensazione.
Calore latente delle principali sostanze
Ecco il calore latente di fusione e di ebollizione delle principali sostanze (in base a quanto detto prima, è possibile ricavare tutti gli altri a partire da questi due):
| Sostanza | Cal. lat. di fusione (J/kg) | Cal. lat. di ebollizione (J/kg) |
| Acqua | 3,335 · 105 | 2,27 · 106 |
| Alcol etilico | 1,08 · 105 | 8,55 · 105 |
| Ammoniaca | 3,39 · 105 | 1,369 · 106 |
| Anidride carbonica | 1,84 · 105 | 5,74 · 105 |
| Azoto | 2,57 · 104 | 2,00 · 105 |
| Elio | 1,25 · 103 | 2,1 · 104 |
| Idrogeno | 5,8 · 104 | 4,55 · 105 |
| Mercurio | 1,1 · 104 | 2,94 · 105 |
| Ossigeno | 1,39 · 104 | 2,13 · 105 |
| Zolfo | 5,4 · 104 | 1,406 · 106 |
Attenzione
Nella curva di riscaldamento e nella curva di raffreddamento di una sostanza il calore latente corrisponde al calore assorbito o rilasciato dalla sostanza durante le soste termiche.