I gas reali (schema generale)
Lo studio dei gas si basa sul modello dei gas ideali, un modello teorico in cui si assume che i gas abbiano determinate caratteristiche, come ad esempio il fatto di contenere particelle che sono puntiformi e che non esercitano alcuna forza attrattiva.
Se però prendiamo in considerazione i gas presenti in natura, notiamo che nessuno di loro rispecchia perfettamente questo modello, perché, per riprendere l’esempio di prima, contengono quasi sempre particelle che non sono puntiformi e che esercitano una forza attrattiva, seppure minima.
I gas che esistono nella realtà e che non presentano le caratteristiche dei gas ideali prendono il nome di gas reali (in altre parole, un gas ideale è un gas che esiste solo a livello teorico, mentre i gas reali sono i gas che si trovano effettivamente in natura).
Differenze tra gas ideali e gas reali
Le differenze tra i gas ideali e i gas reali sono le seguenti:
| Gas ideali | Gas reali |
| Le molecole sono puntiformi (cioè hanno un volume trascurabile rispetto al volume del gas) | Le molecole non sono puntiformi (cioè non hanno un volume trascurabile rispetto al volume del gas) |
| Non esistono forze di attrazione tra le molecole | Esistono forze di attrazione tra le molecole |
| Gli urti delle molecole contro le pareti del recipiente e contro le altre molecole sono elastici (cioè non comportano una perdita di energia cinetica) | Gli urti delle molecole contro le pareti del recipiente e contro le altre molecole non sono elastici (cioè comportano una perdita di energia cinetica) |
Il fattore di comprimibilità
Per sapere quanto diversamente si comporta un gas reale rispetto a un gas ideale, si usa il cosiddetto fattore di comprimibilità (rappresentato dal simbolo Z), un valore adimensionale che indica quanto è comprimibile un gas rispetto a un altro.
Il fattore di comprimibilità di un gas ideale vale sempre 1, per cui più il fattore di comprimibilità di un gas reale si discosta da 1, più il comportamento di tale gas è diverso da quello di un gas ideale.
Il fattore di comprimibilità si ottiene a partire dall’equazione di stato dei gas ideali:
p\ ·V=n\ ·R\ ·T
Riscriviamo l’equazione portando a sinistra tutti i suoi membri:
\frac{p\ ·V}{n\ ·R\ ·T}=\frac{n\ ·R\ ·T}{n\ ·R\ ·T}\frac{p\ ·V}{n\ ·R\ ·T}=\frac{\cancel{n\ ·R\ ·T}}{\cancel{n\ ·R\ ·T}}\frac{p\ ·V}{n\ ·R\ ·T}=1Questo 1 rappresenta il fattore di comprimibilità di un gas ideale. Per ottenere invece il fattore di comprimibilità dei gas reali, basta svolgere questo stesso calcolo usando i valori del gas preso in considerazione (p, V, n…):
Z=\frac{p\ ·V}{n\ ·R\ ·T}È importante ricordarsi che un gas reale si comporta tanto più diversamente rispetto a un gas ideale quanto più bassa è la temperatura e quanto più alta è la pressione.
Facciamo un esempio pratico confrontando, a una temperatura costante di 25°, il fattore di comprimibilità di un gas ideale con i fattori di comprimibilità di due gas reali, l’idrogeno (H2) e il metano (CH4):
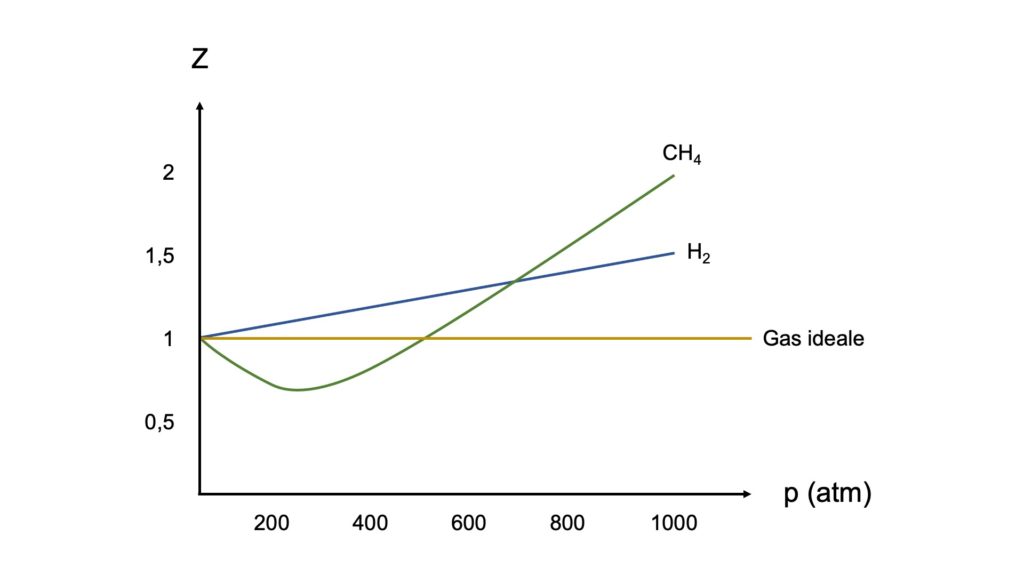
Come possiamo notare osservando il diagramma, il fattore di comprimibilità del gas ideale è sempre 1 a qualsiasi pressione, mentre il fattore di comprimibilità dei due gas reali si allontana da questo valore all’aumentare della pressione:
- se diventa maggiore di 1, significa che il gas reale è meno comprimibile del gas ideale
- se diventa minore di 1, significa che il gas reale è più comprimibile del gas ideale
Attenzione
I gas reali hanno un comportamento simile a quello dei gas ideali solo quando la temperatura è sufficientemente alta e la pressione sufficientemente bassa da rendere trascurabili il volume delle particelle e la loro forza attrattiva. Per il resto, come abbiamo già detto, si comportano in maniera diversa.
Non possiamo quindi descrivere il comportamento dei gas reali attraverso l’equazione di stato dei gas ideali, ma dobbiamo usare l’equazione di Van der Waals, che tiene conto del volume molecolare e delle forze intermolecolari del gas preso in esame (l’equazione di stato dei gas ideali può essere usata per i gas reali solo in caso di alta temperatura e di bassa pressione, cioè quando il comportamento di entrambi i tipi di gas è simile).
