La legge di Boyle (legge isoterma)
La legge di Boyle (nota anche come legge isoterma) dice che, a temperatura costante, il prodotto tra la pressione e il volume di un gas è costante:
p\ ·V=k
Per capire bene questa legge, immaginiamo di avere un gas con un volume di 6 L e una pressione di 2 atm. Se comprimiamo questo gas e dimezziamo il suo volume, la sua pressione raddoppia. Se lo comprimiamo ulteriormente e riduciamo il suo volume a un terzo rispetto a quello di partenza, la sua pressione triplica; e così via. In altre parole, la diminuzione del volume è inversamente proporzionale all’aumento della pressione, per cui il loro prodotto rimane sempre uguale:
6 · 2 = 12
3 · 4 = 12
2 · 6 = 12
Perché ciò avvenga, è necessario che la temperatura rimanga costante (ecco perché la legge è chiamata anche “isoterma”). Inoltre, il gas non deve essere troppo compresso e la sua temperatura deve essere lontana dalla temperatura di liquefazione.
Che cosa succede alle particelle del gas?
Per capire come mai il volume sia inversamente proporzionale alla pressione, dobbiamo osservare da vicino le particelle del gas. Infatti, in base alla teoria cinetico-molecolare sappiamo che il comportamento macroscopico di un gas dipende dal suo comportamento microscopico (cioè che la temperatura, la pressione e il volume di un gas sono variabili legate al comportamento delle sue particelle).
Quando il gas ha un certo volume (V1) e una certa pressione (p1), le sue particelle urtano le pareti del recipiente circostante con una certa frequenza. Se dimezziamo il volume (V2), la frequenza degli urti raddoppia e di conseguenza raddoppia anche la pressione (p2); e così via. Ecco spiegato perché sono inversamente proporzionali. Ma allora perché la temperatura deve rimanere costante? Perché altrimenti la velocità delle particelle, che è legata alla temperatura, cambierebbe, alterando così la frequenza degli urti (più le particelle si muovono, più urtano le pareti) e di conseguenza la pressione.
La seguente immagine può aiutare a capire meglio ciò che avviene a livello microscopico:
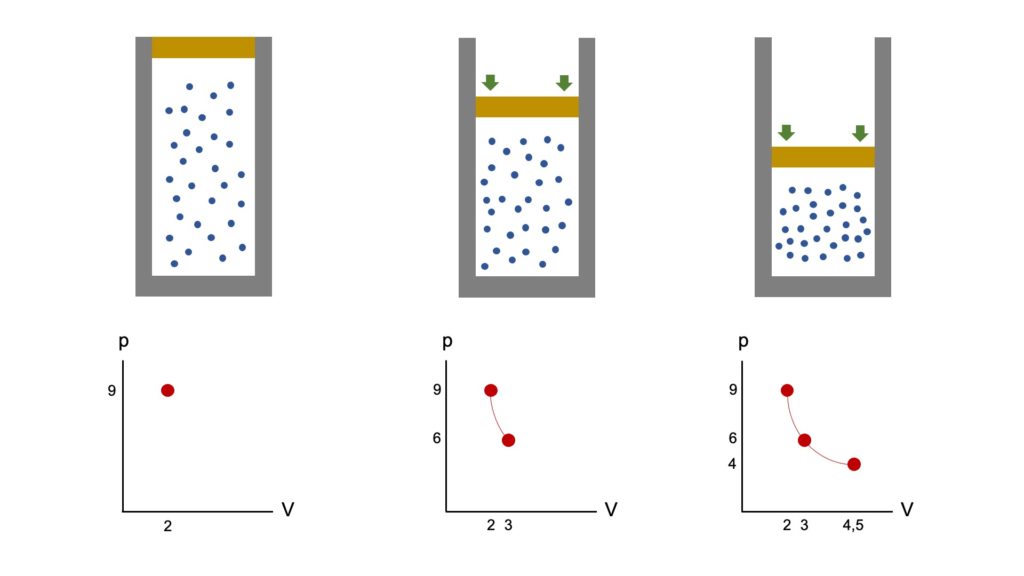
A mano a mano che comprimiamo il gas, le particelle sbattono con maggiore frequenza contro le pareti del recipiente, per cui la pressione sale. Passiamo così da V1 e p1 (9 e 2) a V2 e p2 (5 e 3) a V3 e p3 (4 e 4,5) e in tutti questi casi il prodotto tra volume e pressione rimane sempre uguale. Possiamo pertanto scrivere:
p1 · V1 = p2 · V2 = p3 · V3
E quindi:
9 · 2 = 6 · 3 = 4 · 4,5 = 18
Rappresentazione grafica (curva isoterma)
Questa correlazione tra la pressione e il volume di un gas corrisponde graficamente a un ramo di iperbole equilatera, che prende il nome di curva isoterma:
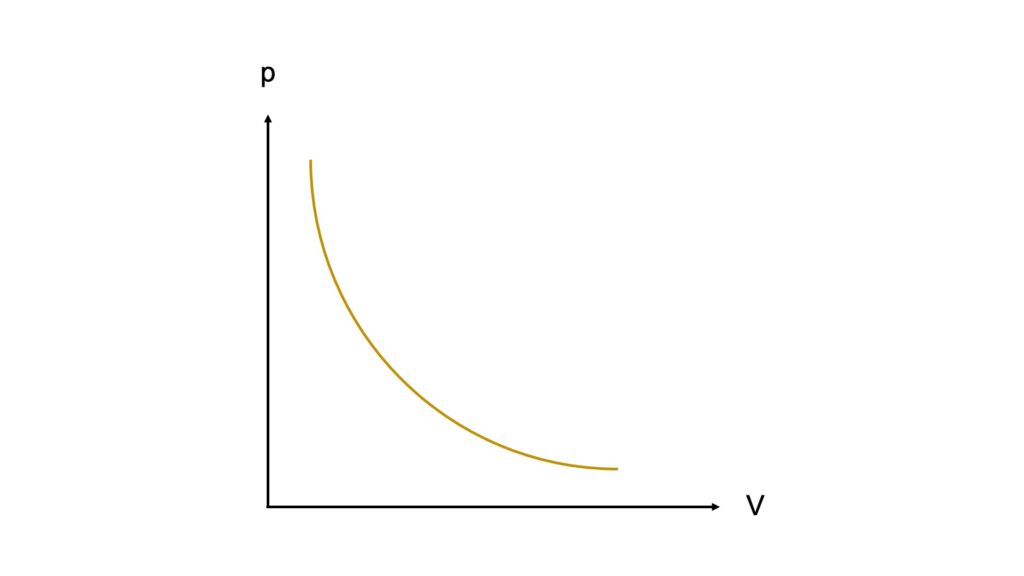
Come possiamo notare, all’aumentare della pressione si verifica una diminuzione del volume (e viceversa). Ciò vale per tutti i gas, dato che la legge di Boyle è una delle leggi dei gas ed è quindi applicabile a tutti i gas (assumendo che i gas si comportino come un gas ideale).
Calcolare pressione e volume con la legge di Boyle
Se il volume (V1) e la pressione (p1) di un gas a un certo punto cambiano, come facciamo a sapere quanto misura il suo nuovo volume (V2), conoscendo la sua nuova pressione (p2) e presupponendo che la temperatura rimanga costante? Per rispondere a questa domanda, non dobbiamo fare altro che moltiplicare V1 e p1, dopodiché ci basta dividere il loro risultato per p2 (in altre parole, è sufficiente trovare il numero che, moltiplicato per p2, dà lo stesso risultato che otteniamo moltiplicando V1 per p1):
| V1 | = | 12 L |
| p1 | = | 4 atm |
| V2 | = | ? |
| p2 | = | 6 atm |
Pertanto:
p1 · V1 = 4 · 12 = 48
p2 · V2 = 6 · x = 48
E quindi:
\frac{48}{6}=8\ LSe dovessimo trovare la nuova pressione invece del nuovo volume, il procedimento sarebbe ovviamente lo stesso.
