La legge di Dalton (pressioni parziali)
La legge di Dalton, nota anche come legge delle pressioni parziali, dice che la pressione totale di una miscela di gas è uguale alla somma delle pressioni parziali dei gas che compongono tale miscela:
p_{tot}=p_1+p_2+p_3+...La seguente immagine può aiutare a capire meglio questa legge:
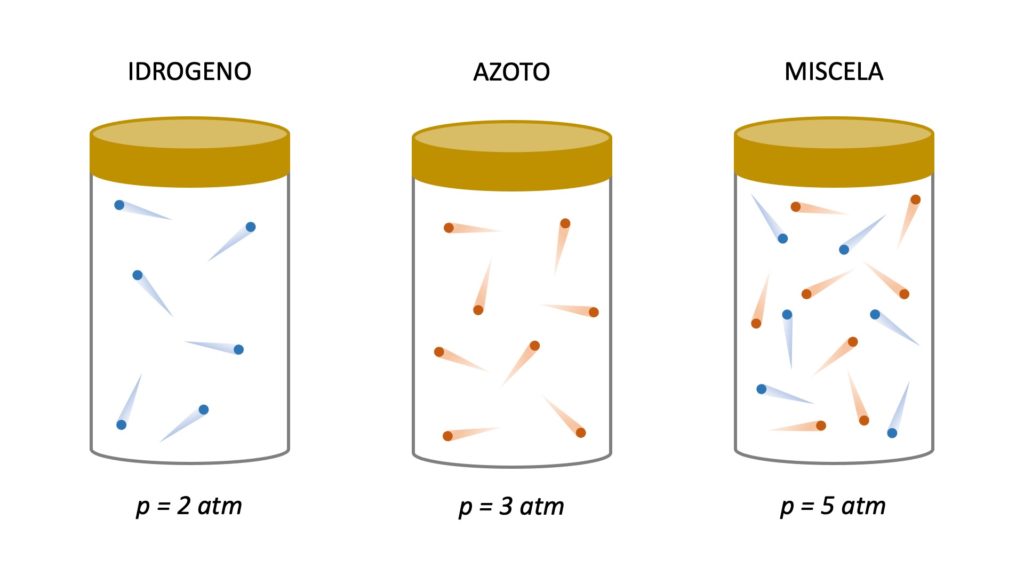
Come possiamo notare, se prendiamo una certa quantità di idrogeno che esercita una pressione di 2 atm e la mescoliamo con una certa quantità di azoto che esercita una pressione di 3 atm, la miscela che si forma eserciterà una pressione di 5 atm. In altre parole, la pressione totale della miscela è uguale alla somma delle singole pressioni dei gas che la compongono (le singole pressioni di tali gas vengono definite pressioni parziali).
Ciò vale soltanto se la temperatura e il volume non cambiano (se infatti variassero, varierebbe anche la pressione). Per riprendere l’esempio di prima, se l’idrogeno e l’azoto avessero una temperatura di 20° e la miscela avesse invece una temperatura di 30°, la pressione della miscela non sarebbe più uguale alla somma delle pressioni dei due gas da cui è composta.
Calcolo delle pressioni parziali
La pressione parziale di un gas all’interno di una miscela si calcola in questo modo:
p_i=\frac{n_i\ ·p_{tot}}{n_{tot}}Dove:
- pi è la pressione parziale
- ni è il numero di moli del singolo gas
- ptot è la pressione totale
- ntot è il numero di moli della miscela
Per ottenere questa formula, bisogna partire dall’equazione di stato del singolo gas:
p_i\ ·V=n_i\ ·R\ ·T
Portiamo ora a sinistra il numero di moli del gas:
\frac{p_i}{n_i}=\frac{R\ ·T}{V}A questo punto prendiamo l’equazione di stato della miscela:
p_{tot}\ ·V=n_{tot}\ ·R\ ·TPortiamo anche qui a sinistra il numero di moli:
\frac{p_{tot}}{n_{tot}}=\frac{R\ ·T}{V}Siccome R, T e V sono uguali in entrambe le formule (R è infatti la costante universale dei gas, mentre la temperatura e il volume sono gli stessi sia per il singolo gas sia per la miscela), possiamo scrivere:
\frac{p_{i}}{n_{i}}=\frac{p_{tot}}{n_{tot}}Otteniamo così la formula da cui siamo partiti:
p_i=\frac{n_i\ ·p_{tot}}{n_{tot}}La frazione molare
Il rapporto tra il numero di moli di un singolo gas e il numero di moli della miscela prende il nome di frazione molare e viene indicato con il simbolo χ (si legge chi):
\chi_i=\frac{p_i}{n_i}Possiamo quindi riscrivere la formula con cui ottenere la pressione parziale di un gas in questo modo:
p_i=\chi_i\ ·p_{tot}Attenzione
La legge di Dalton vale per qualsiasi miscela di gas, assumendo che i gas che la compongono si comportino come gas ideali.
L’esempio più noto di miscela di gas è l’aria, che è formata da azoto, ossigeno, argon, anidride carbonica e altri gas in quantità minore.
