Legge di Lavoisier (conservazione della massa)
La legge di Lavoisier, nota anche come legge di conservazione della massa, dice che in una reazione chimica la massa totale dei reagenti è uguale alla massa totale dei prodotti.
Facciamo un esempio pratico per capire meglio questa legge.
Se prendiamo un pezzo di legno e lo bruciamo, il pezzo di legno si trasforma in cenere. A prima vista, potremmo pensare che la massa del pezzo di legno si sia ridotta (in altre parole, potremmo pensare che la quantità di materia che abbiamo adesso sia minore di quella iniziale).
In realtà, tenendo conto di tutte le sostanze che si sono formate durante la combustione e sommando quindi alla massa della cenere anche la massa del gas che si è prodotto, scopriremmo che tali masse insieme equivalgono alla massa del pezzo di legno.
Se infatti mettessimo su una bilancia il pezzo di legno e lo coprissimo con una campana di vetro, in modo che nessuna sostanza si disperda nell’ambiente, alla fine della combustione la bilancia segnerebbe lo stesso peso, perché la massa totale all’interno della campana di vetro è rimasta la stessa:
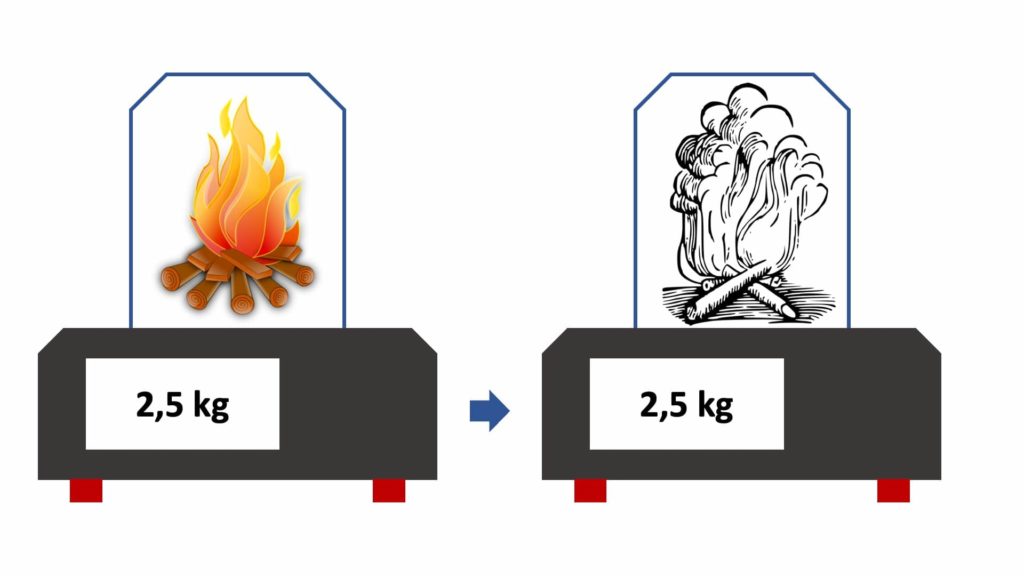
Di conseguenza, possiamo dire che nulla si crea, nulla si distrugge, ma tutto si trasforma, cioè che nessuna reazione chimica è accompagnata dalla creazione o dalla distruzione di materia, ma semplicemente da una sua trasformazione (ad esempio, il pezzo di legno che brucia non scompare nel nulla, ma si trasforma in cenere e gas).
Il comportamento degli atomi in una reazione chimica secondo la legge di Lavoisier
Quello che di fatto avviene durante una reazione chimica è che gli atomi dei reagenti assumono una disposizione diversa rispetto a prima, senza però che il loro numero cambi.
Ad esempio, quando il carbonio e l’ossigeno reagiscono e formano il diossido di carbonio, gli atomi di partenza si dispongono in un altro modo, ma la loro quantità rimane invariata:
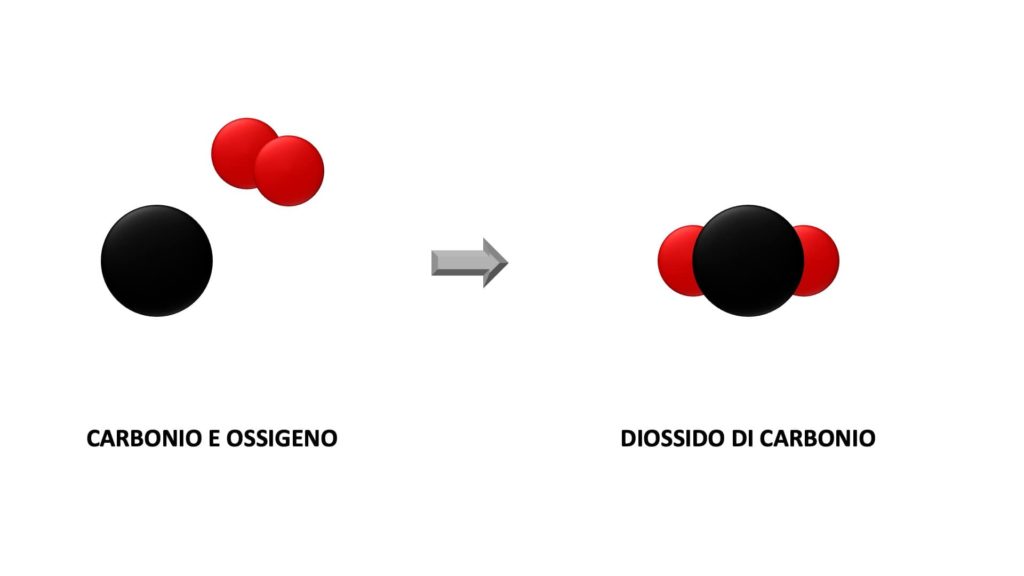
Per questo motivo, quando ci troviamo di fronte a un’equazione chimica, che non è altro che la rappresentazione in simboli di una reazione chimica, dobbiamo bilanciarla, cioè fare in modo che gli atomi dei reagenti siano numericamente uguale agli atomi dei prodotti (se così non fosse, la legge di Lavoisier non sarebbe rispettata):
H2 + Cl2 → HCl
Qui ad esempio l’idrogeno e il cloro si combinano e formano l’acido cloridrico.
Come possiamo notare, a sinistra abbiamo due atomi di idrogeno e due atomi di cloro, mentre a destra abbiamo un solo atomo di idrogeno e un solo atomo di cloro.
Dobbiamo quindi riscrivere l’equazione in questo modo:
H2 + Cl2 → 2HCl
Il coefficiente stechiometrico 2 che abbiamo aggiunto davanti alla formula chimica dell’acido cloridrico indica che in tale sostanza tutti gli indici devono essere moltiplicati per 2, facendoci così ottenere anche a destra due atomi di idrogeno e due atomi di cloro.
