Massa atomica e massa molecolare
Che cosa sono la massa atomica e la massa molecolare? E come si calcolano?
La massa atomica (nota anche come massa atomica assoluta) è la massa di un atomo espressa in grammi o in chilogrammi.
Dato però che gli atomi sono estremamente piccoli, è scomodo usare questo tipo di misurazione, perché per indicare le loro masse dovremmo continuamente fare ricorso a potenze con esponente negativo:
| 2,107 · 10-22 g | ma dello iodio |
| 3,154 · 10-23 g | ma del fluoro |
| 2,657 · 10-23 g | ma dell’ossigeno |
Per risolvere questo problema, è stata scelta un’unità di riferimento a cui paragonare le varie masse atomiche. In questo modo non è necessario esprimerle in grammi o in chilogrammi, ma basta dire quante volte una massa atomica è maggiore rispetto all’unità di riferimento.
L’unità di riferimento, chiamata unità di massa atomica o dalton, è un dodicesimo della massa atomica del 12C (carbonio-12) ed equivale a 1,6605 · 10-24 g.
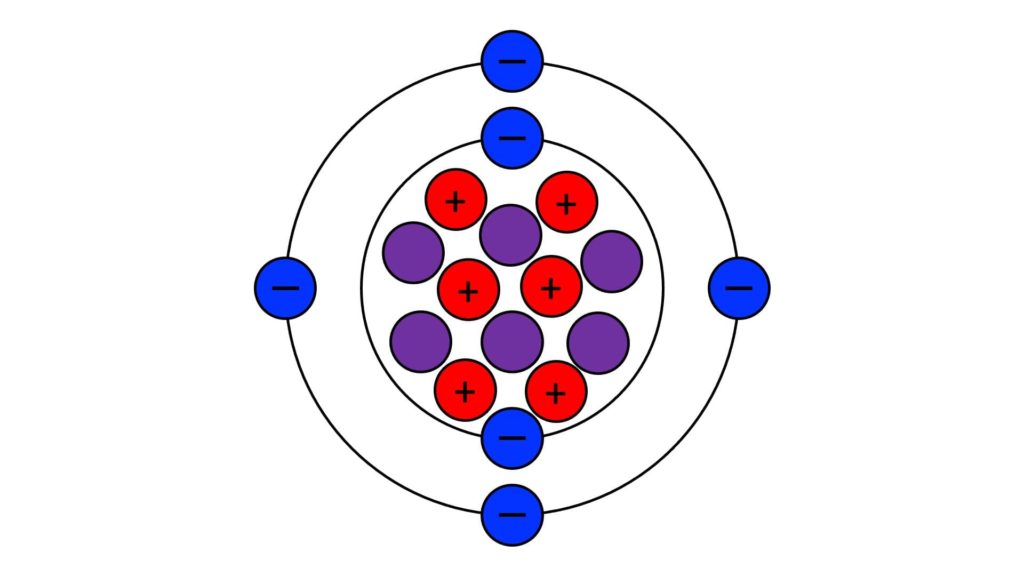
Facendo il rapporto tra una qualsiasi massa atomica e l’unità di massa atomica, possiamo sapere a quante unità corrisponde la massa atomica che abbiamo preso in considerazione. Ad esempio, l’ossigeno corrisponde a 16 unità (in altre parole, la massa di un atomo di ossigeno è sedici volte più grande della massa di un dodicesimo della massa di carbonio-12).
Questo rapporto prende il nome di massa atomica relativa (MA), nota anche come peso atomico (PA).
La massa atomica relativa rappresenta quindi un confronto e pertanto non è espressa in grammi o in chilogrammi: è infatti una grandezza adimensionale, cioè priva di un’unità di misura. Tuttavia, nella pratica comune viene quantificata in unità di massa atomica o in dalton (u o uma sono le abbreviazioni di unità di massa atomica, Da è l’abbreviazione di dalton):
MA=\frac{3,154\ ·{10}^{-23}\ g}{1,6605\ ·{10}^{-24}\ g}=19\ uQui ad esempio abbiamo la massa atomica relativa del fluoro (possiamo indicarla anche con 19 Da).
La massa atomica relativa di ciascun elemento è indicata sulla tavola periodica.
La massa molecolare
Tutto ciò che abbiamo visto per gli atomi vale anche per le molecole. Anche nel loro caso esiste infatti sia una massa molecolare sia una massa molecolare relativa.
La massa molecolare (nota anche come massa molecolare assoluta) è la massa di una molecola espressa in grammi o in chilogrammi ed è data dalla somma delle masse atomiche di tutti gli atomi che la compongono.
Se prendessimo ad esempio una molecola di cloruro di sodio (NaCl), che è formata da un atomo di sodio e da un atomo di cloro, la sua massa molecolare sarebbe uguale alla somma della massa atomica del sodio e della massa atomica del cloro:
m_m=(3,818\ ·{10}^{-23}\ g)+(5,887\ ·{10}^{-23}\ g)=9,705\ ·{10}^{-23}La massa molecolare relativa (MM), nota anche come peso molecolare (PM), si ottiene invece sommando le masse atomiche relative di tutti gli atomi che compongono la molecola.
Se ad esempio prendessimo una molecola d’acqua (H2O), che è formata da due atomi di idrogeno e un atomo di ossigeno, la sua massa molecolare sarebbe:
MM=1+1+16 =18\ u
Se una molecola è monoatomica, cioè è formata da un solo atomo, la sua massa molecolare relativa è uguale alla massa atomica relativa dell’atomo.
