Bilanciamento redox in ambiente basico
Come si fa il bilanciamento delle reazioni redox in ambiente basico? Vediamolo insieme.
Le reazioni redox sono reazioni chimiche in cui avviene un trasferimento di elettroni da una specie chimica a un’altra.
Un esempio di bilanciamento redox in ambiente basico
Vediamo con un esempio pratico come bilanciare una reazione redox che si verifica in ambiente basico (cioè in cui ci sono più ioni OH– che ioni H+):
Cr(OH)3(s) + ClO–(aq) → CrO42-(aq) + Cl2(g)
Utilizziamo il metodo delle semireazioni, che è quello più adatto per questo genere di bilanciamenti.
La prima cosa da fare è assegnare il numero di ossidazione a tutte le specie chimiche presenti:
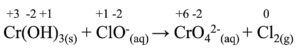
A questo punto dividiamo l’equazione chimica nelle due semireazioni:
Riduzione
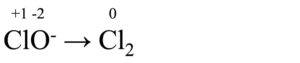
Ossidazione
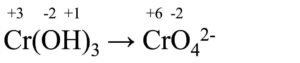
Bilanciamo ora le masse di ciascuna semireazione, aggiungendo poi una molecola di H2O per ogni atomo di O e uno ione H+ per ogni atomo di H:
2ClO– + 4H+ → Cl2 + 2H2O
Cr(OH)3 + 4H2O + 6H+ → CrO42- + 3H2O + 11H+
La semireazioni di ossidazione può essere poi semplificata così:
Cr(OH)3 + H2O → CrO42- + 5H+
Adesso calcoliamo il numero di elettroni acquistati e ceduti nelle due semireazioni.
Dato che per ogni elettrone acquistato il n.o. diminuisce di 1, mentre per ogni elettrone ceduto il n.o. aumenta di 1, sappiamo che:
- Cl ha acquistato 2 elettroni (da +2 è passato a 0)
- Cr ha ceduto 3 elettroni (da +3 è passato a +6)
Ricordiamoci che il n.o. deve essere moltiplicato per l’indice e per il coefficiente stechiometrico della specie chimica, quando calcoliamo gli elettroni acquistati e ceduti.
Sommiamo ora questi elettroni alle rispettive semireazioni, bilanciando così la carica sia della riduzione sia dell’ossidazione:
2ClO– + 4H+ + 2e– → Cl2 + 2H2O
Cr(OH)3 + H2O → CrO42- + 5H+ + 3e–
Terminati questi passaggi, bilanciamo il numero di elettroni acquistati e ceduti. Per farlo, riduciamo ai minimi termini 3 e 2, moltiplicando poi per ciascun risultato la reazione della specie chimica opposta:
\frac{3}{1}=3\frac{2}{1}=2Moltiplichiamo quindi per 3 la semireazione di ossidazione e per 2 la semireazione di riduzione:
2Cr(OH)3 + 2H2O → 2CrO42- + 10H+ + 6e–
6ClO– + 12H+ + 6e– → 3Cl2 + 6H2O
Adesso uniamo le due semireazioni (semplificando le specie chimiche uguali):
2Cr(OH)3 + 2H+ + 6ClO– → 2CrO42- + 3Cl2 + 4H2O
Se la reazione avvenisse in ambiente acido, il bilanciamento terminerebbe qui.
Dato però che siamo in ambiente basico, dobbiamo contare gli ioni H+ e aggiungere lo stesso numero di ioni OH– sia a sinistra sia a destra della freccia (in pratica, trasformiamo gli ioni H+ in molecole di H2O nella parte in cui ci sono ioni H+, mentre aggiungiamo ioni OH– nell’altra parte):
2Cr(OH)3 + 2H+ + 6ClO– + 2OH– → 2CrO42- + 3Cl2 + 4H2O + 2OH–
Pertanto:
2Cr(OH)3 + 2H2O + 6ClO– → 2CrO42- + 3Cl2 + 4H2O + 2OH–
Semplifichiamo infine le molecole d’acqua:
2Cr(OH)3 + 6ClO– → 2CrO42- + 3Cl2 + 2H2O + 2OH–
