Il numero di ossidazione
Il numero di ossidazione (n.o.) o stato di ossidazione è la carica che assumerebbe un elemento in un composto, se tutti gli elettroni di legame fossero assegnati all’atomo più elettronegativo del composto.
Cerchiamo di capire bene questa definizione passo per passo con un esempio pratico.
Ogni elemento ha degli elettroni che ruotano intorno al nucleo dell’atomo e che sono disposti su uno o più gusci, cioè su uno o più livelli:
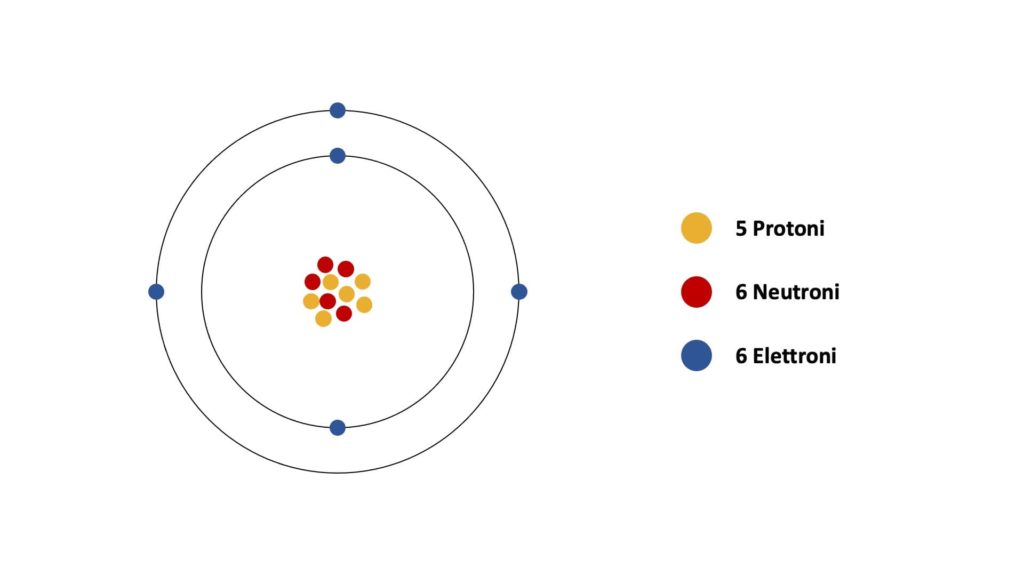
Questo ad esempio è l’atomo del boro. Nel primo guscio ci sono 2 elettroni, mentre nel secondo guscio ci sono 3 elettroni.
Gli elettroni del guscio più esterno prendono il nome di elettroni di valenza e numericamente corrispondono al gruppo di cui fa parte l’elemento sulla tavola periodica. Ad esempio, il boro appartiene al terzo gruppo, per cui ha 3 elettroni di valenza.
Quando si forma un legame tra due o più atomi, può capitare che un atomo sia più elettronegativo dell’altro (o degli altri) e che quindi attiri a sé gli elettroni di valenza dell’atomo (o degli atomi) con cui si lega.
Vediamo ad esempio quello che succede tra l’idrogeno e il cloro, che legandosi insieme formano l’acido cloridrico:
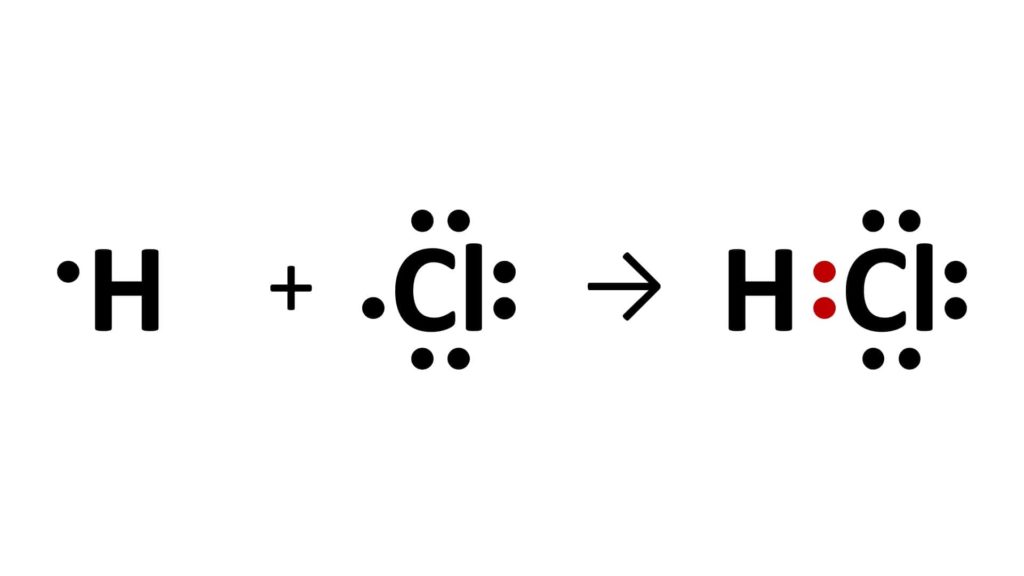
Come possiamo notare, l’idrogeno ha 1 elettrone di valenza, mentre il cloro ne ha 7.
Quando questi due atomi si avvicinano, il cloro, cioè l’atomo più elettronegativo tra i due, attira l’elettrone dell’idrogeno, dando così origine a un legame.
Gli elettroni di valenza che formano il legame prendono il nome di elettroni di legame e vengono assegnati all’atomo più elettronegativo (cioè vengono conteggiati come elettroni dell’atomo più elettronegativo).
Facendo la differenza tra gli elettroni di valenza di un atomo e gli elettroni che gli rimangono dopo l’assegnazione degli elettroni di legame, otteniamo il numero di ossidazione:
H
Ha 1 elettrone di valenza, dopo l’assegnazione ne ha 0
1 – 0 = +1
C
Ha 7 elettroni di valenza, dopo l’assegnazione ne ha 8
7 – 8 = -1
Pertanto, l’idrogeno ha numero di ossidazione +1, mentre il cloro -1.
Il numero di ossidazione si scrive sopra il simbolo dell’elemento:

A che cosa serve il numero di ossidazione?
Conoscere il numero di ossidazione degli elementi di un composto ci permette non soltanto di confrontare le cariche di tali elementi all’interno del composto, ma di distinguere una reazione normale da una reazione redox.
Nelle reazioni normali infatti i numeri di ossidazione degli elementi rimangono gli stessi, mentre nelle reazioni redox cambiano (questo perché nelle reazioni redox avviene un trasferimento di elettroni):
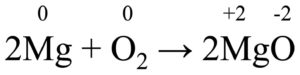
Questa ad esempio è una reazione redox, perché nel passaggio dai reagenti ai prodotti c’è una variazione dei numeri di ossidazione.
Come ricavare velocemente il n.o.
Se vogliamo conoscere il numero di ossidazione di un elemento all’interno di un composto, non è necessario calcolare ogni volta la differenza tra gli elettroni di valenza e gli elettroni rimasti dopo l’assegnazione degli elettroni di legame, perché sulla tavola periodica sono riportati i numeri di ossidazione più comuni di ciascun elemento.
Inoltre, le seguenti regole ci permettono di ricavare con ulteriore rapidità il numero di ossidazione di cui abbiamo bisogno:
1) Il n.o. delle sostanze allo stato elementare (cioè formate da un unico elemento) è sempre 0:
| Sostanza | n.o. |
| Na | 0 |
| Cl2 | 0 |
2) Il n.o. dell’idrogeno è sempre +1, ma negli idruri diventa -1:
| Sostanza | n.o. di H |
| HCl | +1 |
| LiH | -1 |
3) Il n.o. dell’ossigeno è -2, ma nei perossidi diventa -1:
| Sostanza | n.o. di O |
| Fe2O3 | -2 |
| H2O2 | -1 |
4) In un composto elettricamente neutro la somma algebrica dei n.o. dei vari atomi è sempre uguale a 0:

Qui ad esempio dobbiamo sommare +1 e -1.
Se l’indice di un elemento è diverso da 1, prima della somma dobbiamo moltiplicare il numero di ossidazione dell’elemento per il suo indice:

Qui ad esempio dobbiamo moltiplicare +1 per 2 (idrogeno) e -2 per 4 (ossigeno), per cui sommeremo +2, +6 e -8.
5) Il n.o. degli ioni monoatomici coincide con la loro carica elettrica:
| Ione monoatomico | n.o. |
| Fe2+ | +2 |
| Fe3+ | +3 |
Come possiamo notare, è sufficiente invertire il segno e il numero (ad esempio, 2+ diventa +2).
Possiamo aggiungere che:
- la carica degli ioni dei metalli alcalini è sempre 1+, per cui il loro n.o. è sempre +1
- la carica degli ioni dei metalli alcalino-terrosi è sempre 2+, per cui il loro n.o. è sempre +2
- la carica degli ioni dell’alluminio è sempre 3+, per cui il loro n.o. è sempre +3
6) Negli ioni poliatomici la somma algebrica dei n.o. dei vari atomi deve essere uguale alla carica dello ione:
| Ione poliatomico | n.o. |
| SO42- | -2 |
Sapendo che il n.o dello ione è -2 e che il n.o. dell’ossigeno è -8 (cioè -2 per 4), il n.o. dello zolfo sarà +6 (e infatti in questo modo la somma dei n.o. dei due elementi è -2).
