Il metodo della variazione del numero di ossidazione
Il metodo della variazione del numero di ossidazione è uno dei due procedimenti usati per bilanciare una reazione redox (l’altro è il metodo delle semireazioni).
Questo metodo prevede i seguenti passaggi:
- assegnare il numero di ossidazione a tutte le specie chimiche presenti
- individuare le due specie chimiche in cui il numero di ossidazione cambia
- bilanciare le due specie chimiche
- calcolare il numero di elettroni acquistati e ceduti dalle due specie chimiche
- bilanciare gli elettroni acquistati e ceduti (cioè fare in modo che il numero di elettroni acquistati sia uguale al numero di elettroni ceduti)
- bilanciare tutte le altre specie chimiche
Un esempio di metodo della variazione del numero di ossidazione
Facciamo un esempio pratico:
H2SO4 + NaI → NaIO3 + SO2 + H2O
Innanzitutto, assegniamo a ciascuna specie chimica il giusto numero di ossidazione (per farlo, basta seguire le regole per l’assegnazione del numero di ossidazione):
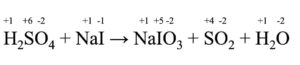
Come possiamo notare, le due specie chimiche in cui il n.o. cambia sono S e I:
- il n.o. di S passa da +6 a +4
- il n.o. di I passa da -1 a +5
Ricordiamoci che l’elemento in cui il n.o. aumenta è quello che si ossida (in questo caso S), mentre l’elemento in cui il n.o. diminuisce è quello che si riduce (in questo caso I).
A questo punto controlliamo il numero di atomi di S e di I e, se ce n’è bisogno, bilanciamo entrambe le specie chimiche con gli opportuni coefficienti stechiometrici.
Dato che sia S sia I hanno un atomo tra i reagenti e un atomo tra i prodotti, non dobbiamo fare alcuna aggiunta.
Adesso calcoliamo il numero di elettroni acquistati e ceduti.
Dato che per ogni elettrone acquistato il n.o. diminuisce di 1, mentre per ogni elettrone ceduto il n.o. aumenta di 1, sappiamo che:
- S ha acquistato 2 elettroni (da +6 è passato a +4)
- I ha ceduto 6 elettroni (da -1 è passato a +5)
Qualora una specie chimica abbia un indice diverso da 1, dobbiamo moltiplicare il suo n.o. per il suo indice. Se avessimo ad esempio S2 al posto di S, dovremmo moltiplicare +6 per 2 e +4 per 2, per cui il suo n.o. passerebbe da +12 tra i reagenti a +8 tra i prodotti.
Questa cosa va fatta anche in caso di coefficiente stechiometrico diverso da 1. Se avessimo ad esempio un 3 davanti alle specie chimiche che contengono S, dovremmo moltiplicare +6 per 3 e +4 per 3, per cui il suo n.o. passerebbe da +18 tra i reagenti a +12 tra i prodotti.
Terminato questo passaggio, bilanciamo il numero di elettroni acquistati e ceduti. Dato che in qualsiasi reazione redox il numero di elettroni acquistati è sempre uguale al numero di elettroni ceduti, dobbiamo fare in modo che S, che ha acquistato 2 elettroni, ne acquisti 6, cioè tanti quanti quelli ceduti da I.
Per farlo, riduciamo ai minimi termini 6 e 2, moltiplicando poi per ciascun risultato la specie chimica opposta:
\frac{6}{2}=3\frac{2}{2}=1Moltiplichiamo quindi per 3 le specie chimiche che contengono S e per 1 le specie chimiche che contengono I:
3H2SO4 + NaI → NaIO3 + 3SO2 + H2O
Così facendo, il n.o. di S diventa +18 (cioè + 6 moltiplicato per 3) tra i reagenti e +12 (cioè +4 moltiplicato per 3) tra i prodotti. Pertanto, gli elettroni acquistati da S diventano 6 (cioè 18-12).
A questo punto non ci rimane che bilanciare tutte le altre specie chimiche come in una normale reazione:
3H2SO4 + NaI → NaIO3 + 3SO2 + 3H2O
