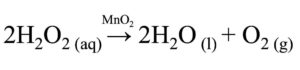Reazioni di decomposizione
Le reazioni di decomposizione sono reazioni chimiche in cui un unico reagente si scinde in due o più prodotti.
L’equazione generale di tali reazioni è la seguente:
AB → A + B
Ad esempio:
CaCO3 → CaO + CO2
Qui il carbonato di calcio si scinde nel monossido di calcio e nel diossido di carbonio.
Di solito tali reazioni si verificano quando il reagente viene scaldato (in questo caso sulla freccia dell’equazione viene aggiunto il simbolo Δ, cioè delta, che indica che è stato somministrato calore).
In queste reazioni il reagente è sempre un composto.
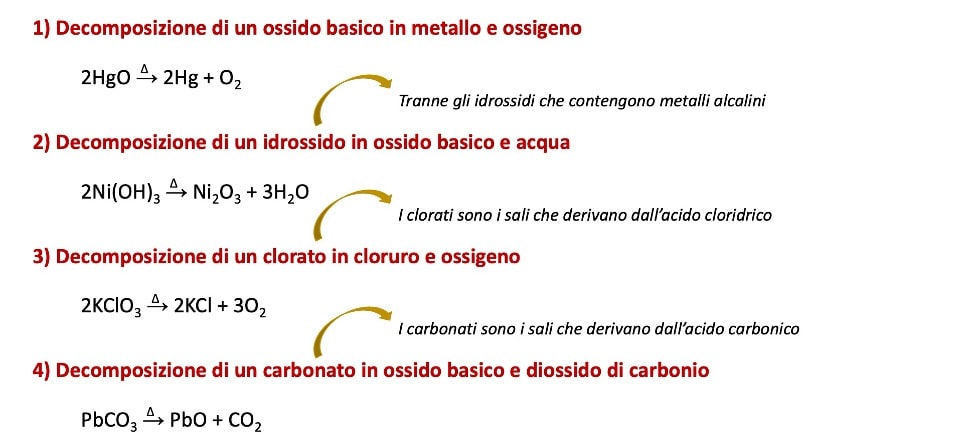
Quattro diverse reazioni di decomposizione
Appartengono a questa categoria le seguenti reazioni:
Più in generale, le reazioni di decomposizione vengono suddivise tra quelle che portano alla liberazione di ossigeno, alla liberazione di anidride carbonica o alla liberazione di acqua.
Vediamo alcuni esempi (oltre a quelli già mostrati prima):
2H2O2 (l) → 2H2O (l) + O2 (g)
CaCO3 (s) → CaO (s) + CO2 (g)
Ni(OH)2 (s) → NiO (s) + H2O (g)
Anche in questo caso le reazioni sono favorite dal riscaldamento del reagente, per cui dobbiamo aggiungere un Δ sopra le frecce.
La decomposizione del perossido di idrogeno (H2O2), conosciuto anche come acqua ossigenata, e la decomposizione del clorato di potassio (KClO3) sono tra i metodi più utilizzati per preparare l’ossigeno in laboratorio.
La decomposizione del carbonato di calcio (CaCO3) è sfruttata a livello industriale per ottenere la calce, che viene poi utilizzata in grandi quantità nel settore edile.
Gli altri tipi di reazioni chimiche
Oltre che di decomposizione, le reazioni chimiche possono essere:
Attenzione
Per produrre l’ossigeno in laboratorio a partire dall’acqua ossigenata, si aggiunge a una soluzione di acqua ossigenata una piccola quantità di diossido di manganese (MnO2).
Dato però che il diossido di manganese non si consuma durante la reazione e non funge quindi da reagente, la sua formula viene scritta sopra la freccia dell’equazione chimica: