Gli ossiacidi (caratteristiche e nomenclatura)
Gli ossiacidi, detti anche ossoacidi, sono composti ternari che si formano in seguito alla reazione di un ossido acido con l’acqua (in altre parole, sono formati da un non metallo, ossigeno e idrogeno):
SO2 + H2O → H2SO3
Qui ad esempio l’anidride solforosa reagisce con l’acqua, formando così l’acido solforoso. Come possiamo notare, nella formula chimica di un ossiacido viene sempre messo prima l’idrogeno, poi il non metallo e infine l’ossigeno.
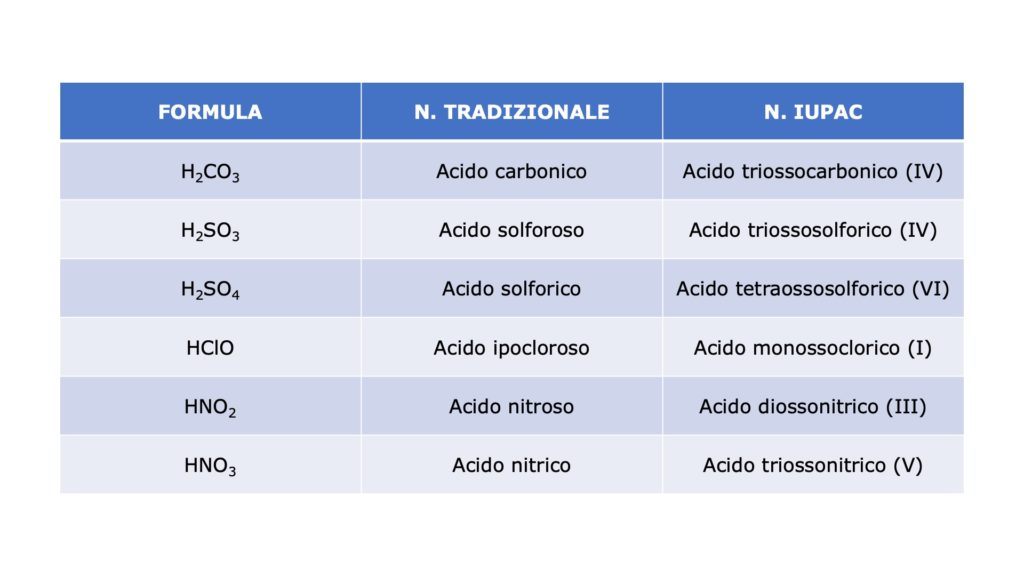
I nomi degli ossiacidi
A seconda che si utilizzi la nomenclatura tradizionale o la nomenclatura IUPAC, gli ossiacidi vengono denominati in questo modo:
Nomenclatura tradizionale
Usiamo il termine acido seguito dalla radice del nome del non metallo con la desinenza -oso (se il non metallo presenta il minore dei due numeri di ossidazione) o -ico (se il non metallo presenta il maggiore dei due numeri di ossidazione).
Ad esempio, l’ossiacido che deriva dallo zolfo con numero di ossidazione +4 prende il nome di acido solforoso e ha formula H2SO3, mentre l’ossiacido che deriva dallo zolfo con numero di ossidazione +6 prende il nome di acido solforico e ha formula H2SO4.
Se il non metallo ha più di due numeri di ossidazione, usiamo:
- il prefisso ipo- e la desinenza -oso per l’ossiacido che deriva dal non metallo con il numero di ossidazione più basso
- il suffisso -oso per l’ossiacido che deriva dal non metallo con il numero di ossidazione intermedio inferiore
- il suffisso -ico per l’ossiacido che deriva dal non metallo con il numero di ossidazione intermedio superiore
- il prefisso per- e la desinenza -ico per l’ossiacido che deriva dal non metallo con il numero di ossidazione più alto
Ad esempio, il cloro ha quattro numeri di ossidazione (+1, +3, +5 e +7), per cui l’ossiacido che deriva da questo non metallo prende il nome rispettivamente di:
- acido ipocloroso (HClO)
- acido cloroso (HClO2)
- acido clorico (HClO3)
- acido perclorico (HClO4)
Se il non metallo ha tre numeri di ossidazione invece di quattro, seguiamo lo stesso schema eliminando la prima opzione.
Un trucco per ottenere più velocemente il nome di un ossiacido è prendere il nome dell’anidride da cui deriva e sostituire anidride con acido. Ad esempio, dall’anidride solforosa deriva l’acido solforoso, mentre dall’anidride solforica deriva l’acido solforico.
Nomenclatura IUPAC
Costruiamo il nome dell’ossiacido seguendo questo schema:
- “acido”
- prefisso che indica il numero di atomi di ossigeno
- “osso”
- radice del nome
- suffisso “ico”
- numero di ossidazione del non metallo in cifre romane tra parentesi
I prefissi che usiamo per indicare il numero di atomi di ossigeno nell’ossiacido sono i soliti della nomenclatura IUPAC:
| 2 | Di- |
| 3 | Tri- |
| 4 | Tetra- |
| 5 | Penta- |
| 6 | Esa- |
| 7 | Epta- |
| 8 | Otta- |
| 9 | Nona- |
| 10 | Deca- |
Facciamo un esempio pratico con il composto che ha formula H2SO3:
- “acido”
- “tri”
- “osso”
- “solfor”
- “ico”
- (IV)
Questo composto prende quindi il nome di acido triossosolforico (IV). Il numero romano tra parentesi si legge come un normale numero cardinale (in questo caso “quattro”).
“Meta”, “orto” e “piro”
Di solito, quando un ossido acido reagisce con l’acqua, ciascuna molecola dell’ossido acido si combina con una sola molecola d’acqua. Tuttavia, in alcuni casi le molecole d’acqua che si combinano possono essere due o tre:
P2O5 + H2O
P2O5 + 2H2O
P2O5 + 3H2O
Dato che l’ossido basico che reagisce con l’acqua è lo stesso, come facciamo a distinguere gli ossiacidi che si formano? È semplice, usando i seguenti prefissi in base al grado di idratazione di ciascun ossiacido (cioè al numero di molecole d’acqua che si sono combinate):
- meta- per l’ossiacido meno idratato
- piro- per l’ossiacido con idratazione intermedia
- orto- per l’ossiacido più idratato
Facciamo un esempio con l’anidride fosforica (P2O5):
| P2O5 + H2O → 2HPO3 | Acido metafosforico |
| P2O5 + 2H2O → H4P2O7 | Acido pirofosforico |
| P2O5 + 3H2O → H3PO4 | Acido ortofosforico |
Questi prefissi vengono usati soltanto nella nomenclatura tradizionale.
