Regola dell’incrocio
La regola dell’incrocio è un procedimento che permette di ricavare la formula molecolare di un composto binario usando il numero di ossidazione dei due elementi che formano il composto.
In base a questa regola il numero di ossidazione del primo elemento diventa l’indice del secondo elemento, mentre il numero di ossidazione del secondo elemento diventa l’indice del primo elemento.
Facciamo un esempio pratico con l’ossido di alluminio, che ha come formula minima AlO.
Dato che il numero di ossidazione dell’alluminio è +3 e il numero di ossidazione dell’ossigeno è -2, la formula molecolare del composto diventa Al2O3:
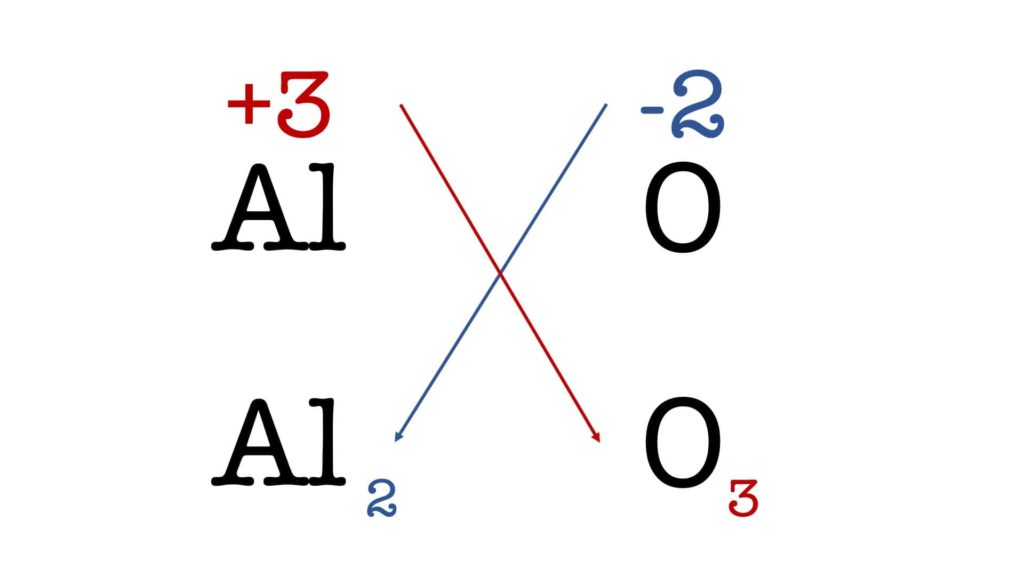
Se i due indici hanno un divisore comune, bisogna ridurli ai minimi termini.
Nell’anidride solforica ad esempio, che ha come formula minima SO, il numero di ossidazione dello zolfo è +6 e il numero di ossidazione dell’ossigeno è -2. Otteniamo quindi S2O6. Dato però che entrambi gli indici sono divisibili per 2, li riduciamo ai minimi termini e otteniamo così SO3.
Perché la regola dell’incrocio funziona sempre?
Il motivo per cui possiamo ottenere gli indici degli elementi di un composto binario attraverso la regola dell’incrocio è che ciascuna molecola di questi composti deve sempre avere una carica complessivamente neutra (la somma dei numeri di ossidazione degli elementi deve cioè essere sempre 0).
Di conseguenza, quando inseriamo come indice di un elemento il numero di ossidazione dell’altro elemento, stiamo automaticamente facendo in modo che la somma dei numeri di ossidazione, una volta moltiplicati per gli indici, diventi 0.
Cerchiamo di capire meglio questa cosa usando di nuovo l’ossido di alluminio.
In questo composto la somma dei numeri di ossidazione dell’alluminio e dell’ossigeno inizialmente non è 0 (se infatti sommiamo +3 e -2, otteniamo +1). Quando però aggiungiamo come indice di ciascun elemento il numero di ossidazione dell’altro elemento e moltiplichiamo di conseguenza i numeri di ossidazione per gli indici che abbiamo inserito, la somma diventa 0 (e infatti otteniamo +6 per l’alluminio e -6 per l’ossigeno).
In questo modo la carica della molecola è sempre complessivamente neutra.
Attenzione
E se un elemento avesse più numeri di ossidazione? In questo caso dobbiamo risalire al numero di ossidazione di cui abbiamo bisogno attraverso il nome del composto, cioè basandoci sulle regole della nomenclatura.
Facciamo un esempio pratico con l’anidride solforica e l’anidride solforosa, due composti formati dallo zolfo e dall’ossigeno (entrambi con formula minima SO).
Il suffisso -ica indica che il numero di ossidazione dello zolfo è +6, mentre il suffisso -osa indica che il numero di ossidazione dello zolfo è +4:
| S2O6 | Solforica |
| S2O4 | Solforosa |
Riducendo ai minimi termini le due formule, otteniamo quindi SO3 (anidride solforica) e SO2 (anidride solforosa).
